

推荐原因:前有CREATE-X试验开启了非pCR三阴性乳腺癌患者强化治疗的先河,但免疫治疗能否加入尚不确定,故本项OXEL研究继续了免疫联合化疗作为辅助治疗在非pCR三阴性乳腺癌患者中免疫疗效的探索。
精华总结:三阴性乳腺癌(TNBC)在诊断后2~3年内远处复发率较高,若想降低疾病复发风险实现病理完全缓解(pCR)非常重要。因此相继开启了在非pCR患者中的研究探索,II期OXEL试验旨在评估新辅助化疗后仍有残留病灶的TNBC患者接受纳武利尤单抗、卡培他滨或联合治疗的免疫学效应。试验结果显示,与单独接受化疗(B组)的患者相比,接受包含纳武利尤单抗免疫治疗的患者(A组和C组)在第6周时的PIS增幅更大;与纳武利尤单抗或卡培他滨单药治疗相比,纳武利尤单抗和卡培他滨联合治疗与中位iDFS和中位OS改善相关。该数据支持ctDNA监测作为识别新辅助或辅助治疗后复发风险高的早期TNBC患者的一种手段。
OXEL试验旨在评估辅助纳武利尤单抗、卡培他滨或双药联合治疗在新辅助化疗后伴残余浸润性疾病的早期三阴性乳腺癌(TNBC)患者中的疗效和安全性。该试验结果在2024年AACR会议中公布,其正文于3月27日在Nature Communications在线发表,具体内容就和小编一起来看看吧。

乳腺癌是全球女性癌症死亡的主要原因,三阴性乳腺癌(TNBC)是其中一种侵袭性亚型,常在年轻女性中诊出率较高,并在诊断后2~3年内具有更高的远处复发率。与残留浸润型乳腺癌患者相比,达到病理完全缓解(pCR)的患者复发风险显着降低,生存结局更优。
根据CREATE-X试验和ECOG-ACRIN EA1131试验结果提示,为降低复发风险,新辅助化疗后残留浸润性病灶患者常使用卡培他滨辅助治疗,但basal-like型TNBC患者的3年无浸润性肿瘤复发生存期(iDFS)仍不到一半,仍需寻求更有效的疗法。
基于KEYNOTE-522试验的结果,FDA已于2021年批准高危早期TNBC患者接受新辅助帕博利珠单抗联合化疗,并在术后继续接受1年帕博利珠单抗辅助治疗。但对于未接受免疫治疗的患者来说,PD-1/PD-L1抑制剂的辅助治疗效果尚待明确,SWOG S141820试验和A-BRAVE21试验也在进行积极探索中。
目前关于纳武利尤单抗、卡培他滨或两者联合对外周免疫评分(PIS)的影响仍不明确,故本项研究者发起的II期OXEL试验旨在评估新辅助化疗后仍有残留病灶的TNBC患者接受纳武利尤单抗、卡培他滨或联合治疗的免疫学效应。

OXEL是一项开放标签的II期随机临床试验,研究纳入完成新辅助化疗和乳房残留浸润性病灶至少1.0cm和/或淋巴结阳性(至少ypN1)的早期TNBC患者为研究对象,以1:1:1的比例随机接受纳武利尤单抗(360mg,Q3W)(A组)、卡培他滨(1250mg/m2,BID,3周周期的第1~14天)(B组)或纳武利尤单抗联合卡培他滨(C组)治疗。
主要终点是评估纳武利尤单抗、卡培他滨或联合用药对外周免疫学特征的影响,次要终点包括循环肿瘤DNA(ctDNA)检测、安全性、2年总生存(OS)率和IDFS率以及ctDNA和外周免疫评分(PIS)与临床结局的相关性。

患者特征
研究纳入符合条件的患者45例,每组患者15例,平均年龄为51岁。93%患者接受过新辅助紫杉烷联合蒽环类药物化疗,31%患者接受过卡铂治疗,76%患者接受过辅助放疗。3例换着为BRCA1/2突变,2例患者为PALB2突变。在45例患者中,42例通过多色流式细胞术进行了外周免疫分析,38例原发性肿瘤组织进行全外显子组测序(WES)和ctDNA检测,35例患者接受了免疫分析和ctDNA检测。
PIS和其他免疫细胞亚群的变化
42例患者外周血单核细胞(PBMC)(A组15例,B组14例,C组13例)在治疗前后6周和12周通过多色流式细胞术评估了158个具有明确生物学功能的免疫细胞亚群。PIS反映免疫功能增强,A组和C组在入组6周后无显著变化,而B组患者PIS降低,维持在12周。通过比较治疗6周和12周时与治疗前PIS变化的百分比,进一步突出了化疗和免疫治疗在免疫学效应的统计学差异。
此外,其他不同的免疫亚群在治疗6周和12周后显示出特异性的统计学变化。治疗6周后,接受卡培他滨(B组)的患者CD8+T细胞减少,幼稚CD4+T细胞、CD73 CD8+T细胞及CD226 NK细胞增加;在治疗12周时,ki67+CD8+T细胞减少,幼稚CD4+T细胞和CD73 CD8+T细胞的增加。治疗6周时,接受联合治疗(C组)的患者常规树突状细胞(cDC)和表达ki67的增殖效应记忆(EM)CD4+T细胞短暂增加,而双阴性(DN)NK细胞在治疗6周和12周时均增加。
生存和复发
中位随访时间为20.4个月时,16例(35.6%)患者发生远处复发,7例(15.6%)患者死亡。总人群的1年iDFS率为73%,2年iDFS率为63%,3年iDFS率为54%;A组、B组和C组的2年iDFS率分别为47%、53%和91%,C组的2年iDFS率较A组和B组更高(图1A)。A组、B组和C组的2年OS率分别为70%、80%和83%,B组和C组的2年OS率较A组更高(图1B)。
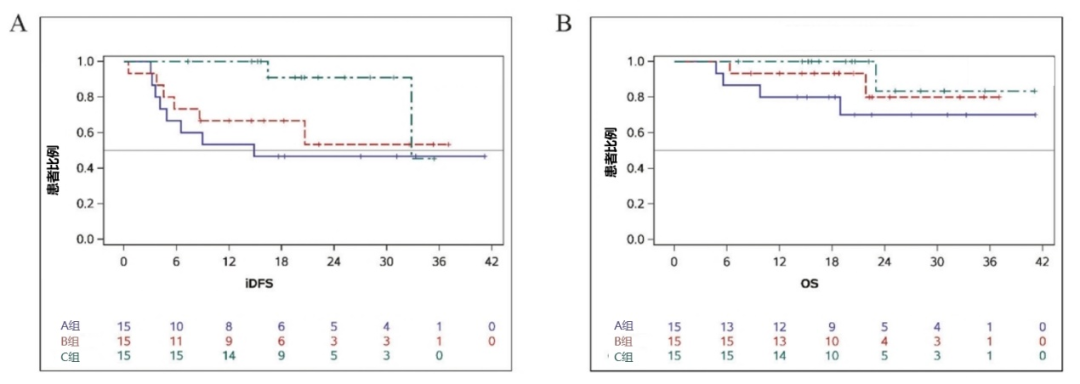
图1. 各治疗组的中位iDFS和OS
安全性
A组的11例患者、B组的14例患者和C组的14例患者至少发生一次药物相关不良事件(AE)。共发生198起任何级别的药物相关AE,其中A组29起(14.6%),B组74起(37.4%),C组95起(48.0%)。7例(15.6%)患者发生药物相关3级AE,其中B组2例(13.3%),C组5例(33%),未发生4级或5级AE。C组的免疫相关不良事件(irAEs)未增加,仅1例患者(C组)因药物相关AE停止治疗。
ctDNA检测与疾病复发
入组的45例患者中,38例患者进行ctDNA检测,13例(34%)患者在研究开始时ctDNA即为阳性,A组、B组和C组的ctDNA阳性率分别为46%、33.3%和30%,组间比较无显著差异。
在中位随访20.4个月时,接受ctDNA检测的38例患者中14例发生远处复发。与ctDNA阴性患者相比,ctDNA阳性患者的中位iDFS暂未达到,为4.52个月(95%CI:3.21-8.98)。
在13例ctDNA阳性患者中,4例在治疗6周时ctDNA呈阴性,其中2例患者在12周时仍保持ctDNA阴性,1例患者转为ctDNA阳性并随后出现远处复发。其余9例ctDNA阳性患者在治疗6周时ctDNA呈阳性并出现远处复发。
在25例ctDNA阴性患者中,24例在治疗6周和12周时均保持ctDNA阴性,其中进4例(16%)患者发生疾病复发,1例患者在治疗6周时ctDNA呈阳性,但在治疗12周时ctDNA呈阴性,并发生远处复发。

本项II期OXEL试验达到了预先指定的主要终点,与单独接受化疗(B组)的患者相比,接受包含纳武利尤单抗免疫治疗的患者(A组和C组)在第6周时的PIS增幅更大;与纳武利尤单抗或卡培他滨单药治疗相比,纳武利尤单抗和卡培他滨联合治疗与中位iDFS和中位OS改善相关。
本试验的结果提供了这种联合治疗方案在TNBC患者中的疗效和安全性数据,并支持前瞻性免疫分析和ctDNA监测的持续发展,作为识别新辅助或辅助治疗后复发风险高的早期TNBC患者的一种手段,以识别高复发风险的患者。
【参考文献】
Lynce F, Mainor C, Donahue RN, et al. Adjuvant nivolumab, capecitabine or the combination in patients with residual triple-negative breast cancer: the OXEL randomized phase II study. Nat Commun. 2024 Mar 27;15(1:2691. doi: 10.1038/s41467-024-46961-x.
合肥科生景肽生物科技有限公司成立于2018年,目前已经打造了全球领先的以肽为核心的生命分子发现、合成生产、结构优化、递送平台,主要瞄准肽发现及靶向递送,专注于为各大制药企业、生物技术公司、科研单位提供一站式的定制化研发服务。 公司独有的KPDS™平台(KS-V Peptide Discovery Services Platform)是国际领先的的多肽药物发现平台,我们致力于创新药物的高效和精准开发,以科生景肽专有KPDS技术为核心,提供一站式,定制化的多肽发现服务,以灵活的产品形式和服务模式助力广大客户各类药物发现项目的快速推进和应用探究,包括但并不限于疾病诊断及保健功能产品、多肽药物、核素偶联药物(RDC)、基于小分子的肽药物偶联物(PDC)和多功能肽偶联物等。中文官网地址:https://www.ks-vpeptide.com.cn/
英文官网地址:https://www.ks-vpeptide.com
领英:https://www.linkedin.com/company/ks-v-peptide/

















