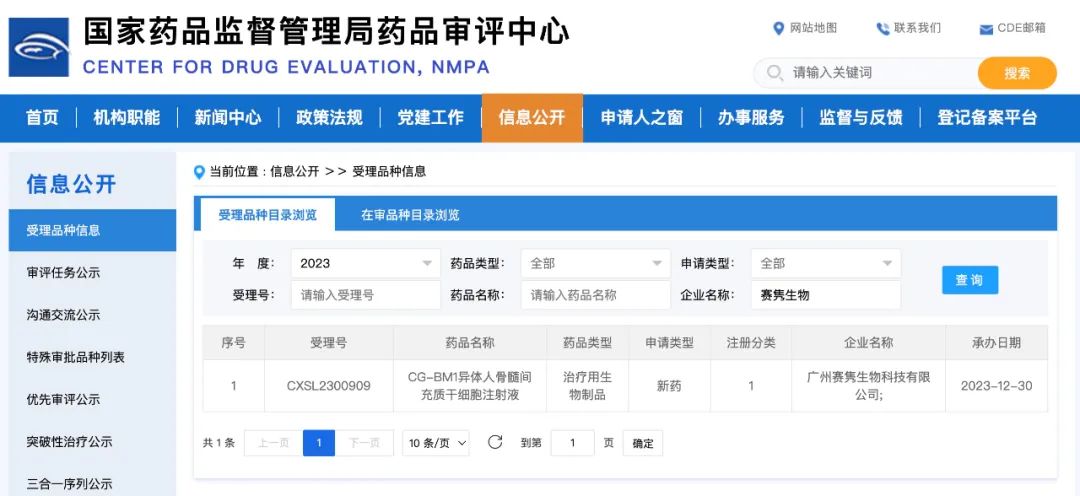
2023年12月30日,广州赛隽生物科技有限公司“CG-BM1异体人骨髓间充质干细胞注射液”的新药临床试验申请(IND)获得国家药品监督管理局药品审评中心的正式受理。该IND申请是赛隽生物干细胞新药的第三项临床试验申请。
此前,赛隽生物已有两项干细胞新药IND获批,适应症分别是“慢加急性肝衰竭(ACLF)”和“感染引起的中重度成人急性呼吸窘迫综合征(ARDS)”,目前临床均开展顺利,预计2024年上半年进入临床II期试验。
中文官网地址:https://www.ks-vpeptide.com.cn/
英文官网地址:https://www.ks-vpeptide.com
领英:https://www.linkedin.com/company/ks-v-peptide/
© 版权声明
THE END
















