前言
理想的药物递送系统,可以通过靶向性和定向释放以起到提高药效、改善给药窗口、降低给药剂量以及减少毒副作用的效果。尤其在癌症治疗领域,靶向递送药物的精准高效杀伤,相较于小分子放化疗药物对于肿瘤细胞和正常细胞的无差别伤害,具有显著优势。
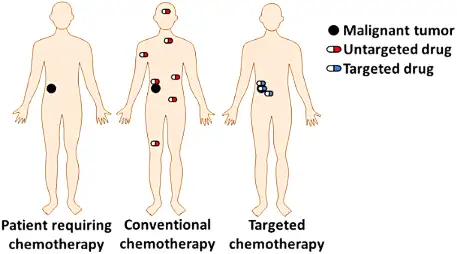
截止今年六月,全球已有14款以抗体作为靶向递送系统的抗体偶联药物ADC(antibody-drug conjugate)获批上市。而同样作为新兴药物类型的多肽偶联药物PDC(peptide-drug conjugate) 则是依靠多肽作为药物递送载体,通过连接子(linker)连接载荷毒素(payload)的药物。相较于ADC,PDC分子量较小(一般 < 8 kDa),具有低免疫原性,物理化学性质可调节,低合成成本等方面的优势。
生物大分子药物一般不经过CYP450酶代谢,主要通过肾小球滤过(<60kDa)、酶水解、分解代谢(Catabolism)等方式清除,和抗体偶联药物ADC相比,分子量相对较小的PDC清除更快,血浆暴露时间更短,脱靶影响副作用相对较小。尽管如此,从安全性和有效性的角度进行考量,靶向性仍然是PDC药物开发中的一个最为重要的设计原则,而代谢产物鉴定的研究对于PDC的药物释放和靶向性评估至关重要。

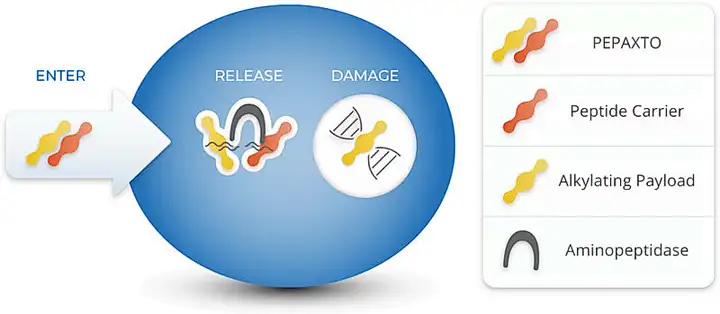
首个获批上市的多肽偶联药物Pepaxto® (melphalan flufenamide),将毒素分子melphalan通过肽键偶联一个氟苯酰胺以提高亲脂性来改善生物利用度。通过被动转运(非蛋白靶点的主动转运)进入细胞后被肿瘤细胞中高表达的氨肽酶水解,实现代谢释放毒素分子[2a]。该设计思路,从某种意义上更类似于前药的设计。
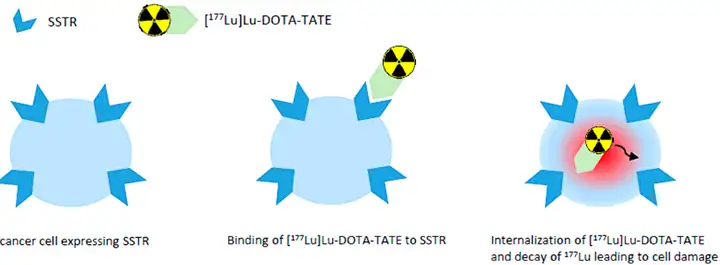
另一类已上市的PDC药物是以多肽作为靶向配体的放射性核素偶联药物(Radionuclide-Drug conjugates, RDC)。如Lutathera® [3]是奥曲肽偶联放射性核素Lu177构成的药物,利用奥曲肽对人SSTR2受体的靶向性,被肿瘤细胞捕获后并不需要通过代谢释放载荷核素即可实现放射性核素的定向放射治疗,Lutathera本身不被肝代谢,以肾清除为主。

目前正在临床/临床前研究阶段的主要PDC项目多为以化疗药物和毒素分子(如紫杉醇、喜树碱、美登素、阿霉素、海兔毒素类的细胞微管抑制剂或者核酸抑制剂)作为载荷的药物。处于偶联状态的大分子具有空间位阻的抑制性,其载荷毒素需要通过代谢降解释放后才能起效。与ADC药物类似,主流PDC都是希望药物在进入靶细胞之前在循环系统保持结构完整和稳定,而在进入靶细胞后能有效释放小分子载荷毒素,即设计思路为:
1)药物的有效递送,依赖于多肽结构的靶向性设计;
2)载荷的精准释放,依赖于靶向性的释放机理。
靶向递送:目标受体与靶向肽
针对肿瘤细胞特殊受体的靶向肽可以使用噬菌体展示技术(phage display technology)等途径,通过受体靶点筛选获得。
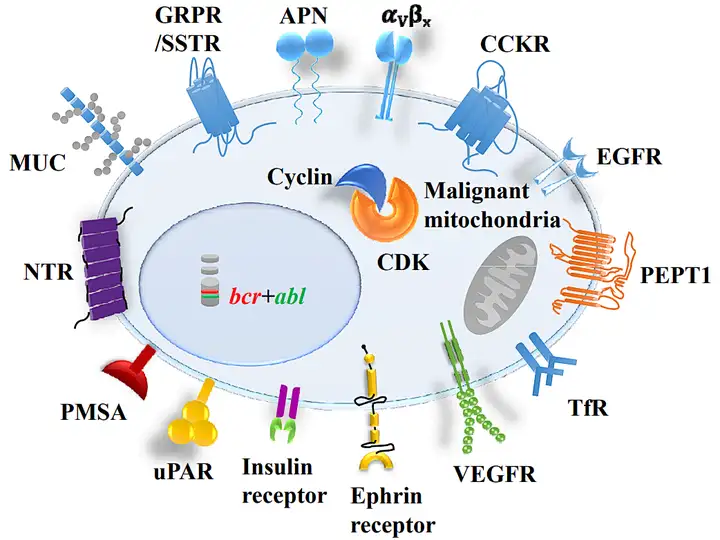
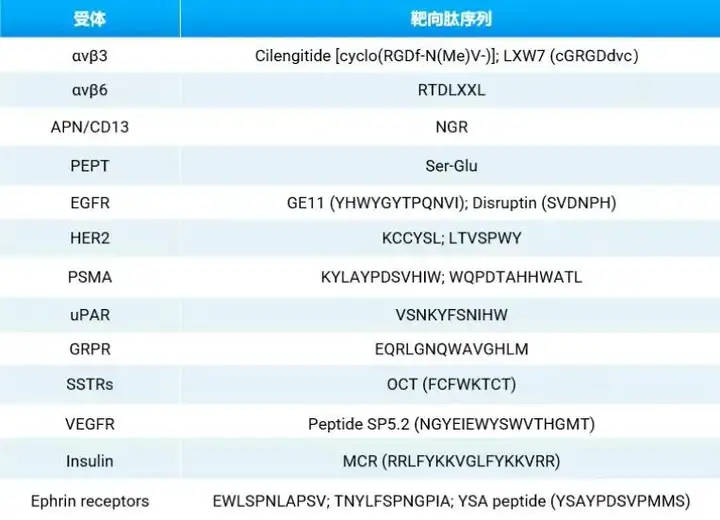
靶向释放:载荷毒素释放机理
PDC药物靶向进入肿瘤细胞后,根据连接子的不同设计可以有不同的载荷释放方式。
1)不可裂解连接子:溶酶体的蛋白水解酶降解其多肽部分后,释放载荷毒素。
2)可裂解连接子: 在肿瘤细胞微环境下的氧化还原、水解(包括在溶酶体中的水解)、等途径发生连接子断裂,从而释放载荷毒素。
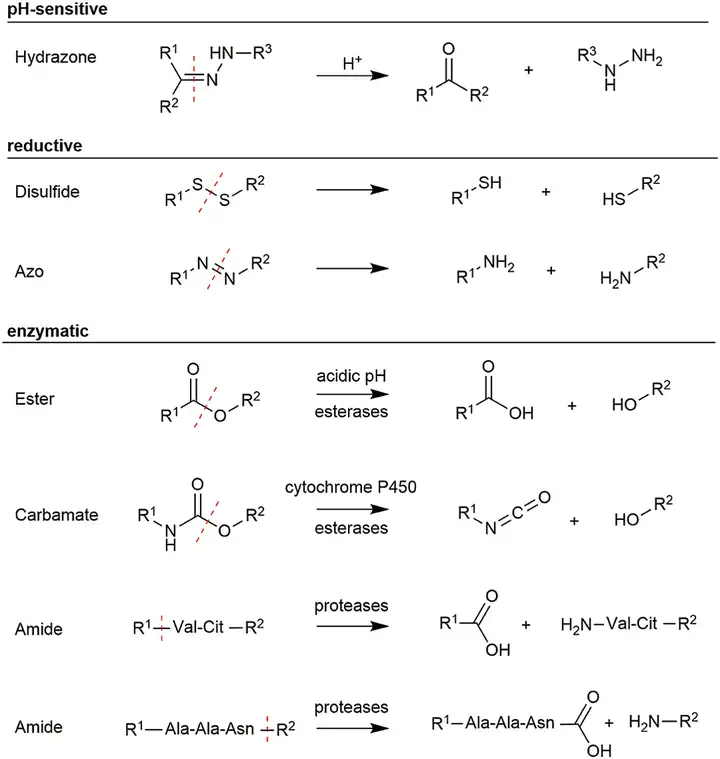
酸切割型连接子利用肿瘤细胞溶酶体(pH<5)和血浆(pH 7.4)的pH差异选择性的在肿瘤细胞内代谢释放出载荷毒素,如腙类结构能在酸性条件下反应分解成醛/酮和胺。
二硫键连接子可以通过谷胱甘肽介导的二硫键还原/交换形成切割释放, 而肿瘤细胞里谷胱甘肽含量超过血液1000倍。偶氮连接子可以在 NADPH-偶氮还原酶的催化下裂解,偶氮还原酶在肿瘤细胞的缺氧环境下过表达。
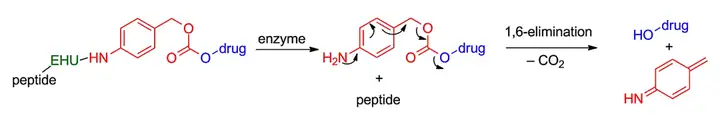
组织蛋白酶B是在肿瘤细胞/组织中高表达的蛋白水解酶。组织蛋白酶B能够识别水解特定的肽序列,如Val-Cit(缬氨酸-瓜氨酸)和GFLG,这些短肽可用来作为定向酶切型连接子。此外当使用酶切型连接子时经常会同时用到自降解基团,如对氨基羧酸苯甲酯(PAB)起到结构控制作用,当连接子水解后,自降解基团发生自发化学消除离去并释放出载荷毒素。
部分在研临床阶段药物举例
目前主要研究PDC药物公司有Angiochem, Bicycle Therapeutics, Cybrexa Therapeutics, Oncopeptides, PeptiDream, Theratechnologies, 博瑞医药等。以下是部分已进入临床阶段的PDC药物,它们由不同的多肽、连接子、载荷毒素构成,其靶向特性和释放机制具有典型代表性。
⚫ AEZS-108[6]
AEZS-108以阿霉素类毒素Doxorubicin作为载荷分子,LHRH肽作为靶向肽,进入细胞后在溶酶体作用下分解代谢释放Doxorubicin, 做到III期临床阶段。
⚫ ANG1005[7]
ANG1005是靶向低密度脂蛋白LRP-1受体的多肽偶联多个紫杉醇的药物,LRP-1在肿瘤细胞表面高表达,并介导药物跨膜进入肿瘤细胞内,并通过溶酶体水解释放出紫杉醇。目前进入临床II/III期阶段。
⚫ CBX-12[8]
CBX-12是由Cybrexa Therapeutics公司开发alphalex™平台,与pHLIP, Inc合作,通过pHLIP®肽、连接子和小分子抗癌剂组成的不依赖于抗原表达的靶向性药物。原理是利用肿瘤细胞特有的酸性低pH环境形成α螺旋并穿透细胞膜,将C-末端连接的毒素分子插入细胞内部,通过二硫键的裂解释放毒素分子。CBX-12作为候选先导化合物,已进入临床I/II期阶段。
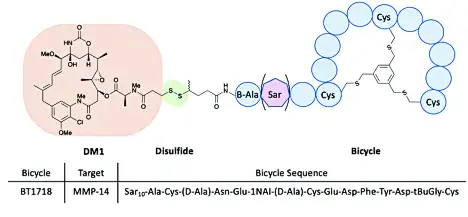
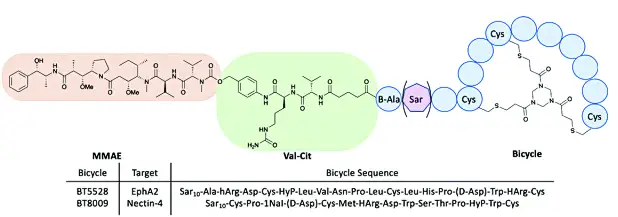
⚫ Bicycle双环肽系列PDC[9]
Bicycle公司的双环肽具有高靶向性稳定性和亲和力。BT1718为可裂解的二硫键连接载荷毒素DM1和双环肽组成,BT8009和BT5528使用MMAE作为载荷毒素,以可裂解二肽Val-Cit作为连接子,现处于临床I/II期状态。
其他PDC的研究热点
利用不同功能肽段和多种位点-切割模式的组合,可以从功能性和靶向性上将多种结构的优势组合起来。Deng[10]等设计了由靶向肽(TTP)-连接肽-穿膜肽(CPP)-毒素分子的多功能肽组合型PDC结构,用LHRH肽靶向肿瘤细胞的LHRH受体,以可被肿瘤组织间高度表达的 MMP2 酶特异降解的多肽 ( PLGLAG) 为连接臂。连接肽降解后毒素分子随穿膜肽导入细胞内,通过穿膜肽的快速水解,或是可裂解连接子的断裂释放出毒素分子。该设计同时运用了利于靶向富集肿瘤细胞的靶向肽和利于转运进入细胞的穿膜肽,以及细胞内和细胞外的两种环境靶向性裂解机制,对靶向性和改善成药性有了新的探索。
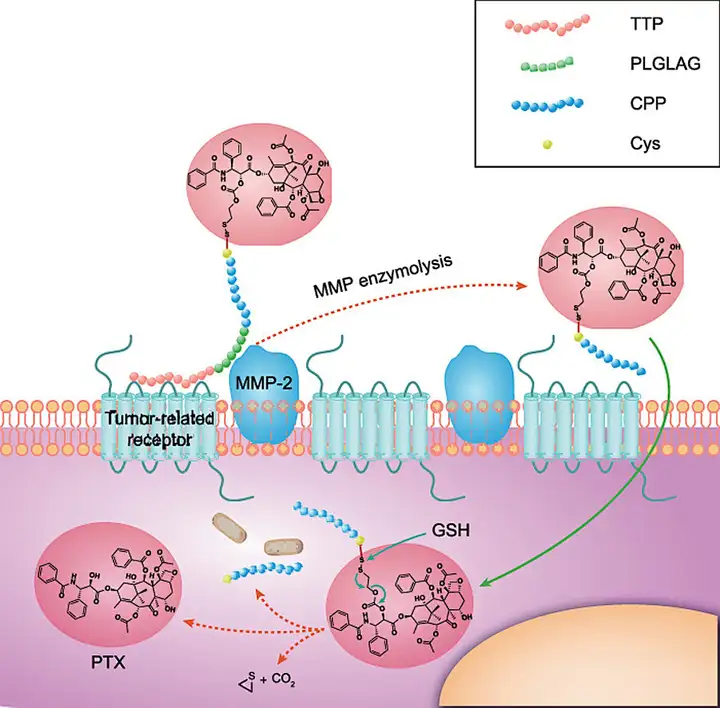
-毒素分子组合的PDC[10]

PDC药物的体内外代谢研究体系
在药物开发的初始阶段,通过体外代谢体系研究,例如酸化肝S9(模拟肿瘤细胞酸性环境下溶酶体)、血浆/全血、肝细胞和肾S9,可以帮助确定PDC的稳定性和靶向性,以及载荷毒素的释放机制。尽早了解PDC药物实际释放出的载荷毒素相关产物的形式,一方面可以帮助优化和改进结构设计,另一方面也为后续药代动力学和毒代动力学提供准确的预期代谢产物相关信息。而临床前动物实验和临床给药则通过体内血浆和尿液等排泄物中的代谢产物鉴定确认PDC药物以及释放的载荷毒素在体内的代谢情况。
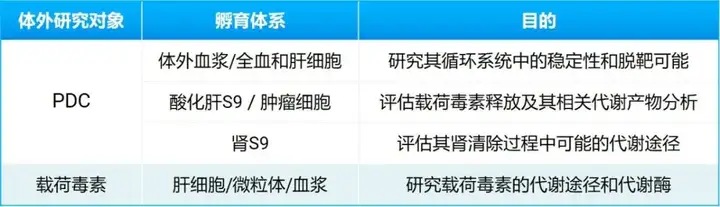

和常规小分子一样,对于载荷毒素本身,或是经鉴定为PDC的主要释放产物(如载荷毒素-连接子等其他主要释放形式),也需要进行类似代谢评估,确定其可能的代谢途径(如图9,常用的载荷毒素MMAE的代谢途径),进而有助于相关的药物相互作用及毒理的研究。
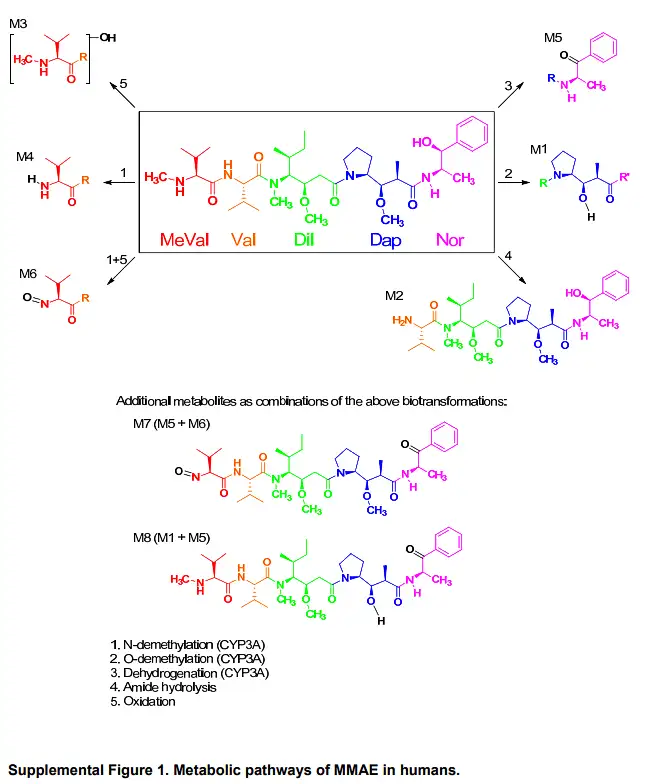
PDC药物代谢产物鉴定的实验方法
PDC的代谢产物鉴定主要运用液相色谱-高分辨质谱(LC-UV-HRMS)的方法,通过前述的体外研究体系孵育获得分析样品或采集的体内样品经蛋白沉淀,离心取上清后进行LC-UV-HRMS分析,如化合物稳定,也可通过浓缩处理后再进行分析。如多肽偏中性,用水/乙腈的反向色谱体系梯度洗脱即可,若多肽为强碱性(如穿膜肽TAT等含有碱性氨基酸残基较多的肽段),流动相也可加入适量的三氟乙酸以改善峰型。
通过液相色谱进行组分分离并找到产物的色谱峰,再通过其质谱的质荷比信息与原药进行比对,根据高分辨质谱的MS和MS2信号分析其代谢变化和代谢位点。
代谢产物分析中的难点和对策
代谢产物的LC-MS分析重点即在于色谱示踪定位和结构解析。色谱示踪定位有放射性同位素法和非同位素法。放射性同位素法(Hot)使用含放射性同位素标记的化合物进行代谢实验,但放射性同位素标记化合物合成复杂,且实验成本和实验室资质要求高,一般不用于前期筛选。非同位素法(Cold)通常依靠与空白基质对比的新增色谱峰进行示踪定位,如LC-UV或LC-MS。由于结构特点,PDC及其主要代谢产物可能存在特征紫外吸收较弱,紫外检测就不能有效示踪定位,此时需要依靠LC-MS背景扣除等数据处理的方法获得二次图谱进行外源性新增峰识别,在色谱上定位可能的产物(如下述案例中图10-图11,D-E-F)。化合物分子大小会影响结构解析的复杂度。PDC与ADC药物相比,由于体积位阻效应,它们的载荷毒素通常都要在释放之后才会发生CYP酶类的代谢,但ADC一般只考虑载荷毒素代谢释放方式及代谢产物,其抗体部分主要通过体内的分解代谢机制降解(Catabolism),而PDC药物的多肽部分和连接子部分都可能受水解酶的影响发生代谢,因此在分析可能的代谢物以及判断代谢变化位点的时候,既需要处理载荷毒素部分,也需处理多肽部分。目前常用的代谢数据处理软件主要是通过代谢特点的质量变化进行搜库匹配,并与基于化学键断裂的穷举匹配结合。因此在进行PDC代谢产物鉴定时,无论是人工分析还是软件计算,随着分子量(化学键数量)的增加,其运算复杂度相较于小分子化合物呈几何数量级增长,因此对于软件和算法的更新升级是提高PDC代谢产物鉴定分析效率的重要因素。
代谢产物分析鉴定的典型案例
下面是我们基于对某PDC的体外代谢研究进行的案例分析,该PDC为环肽和可裂解连接子的类型。
我们对比了该PDC在酸化肝S9(乙酸钠缓冲溶液,pH = 5)和肝细胞(Williams’ Medium E, HEPES和谷氨酸盐的培养基)孵育体系中的不同代谢行为。
在酸化S9孵育体系中,LC-UV谱图只能找到原药和一个代谢产物M1的紫外峰,在LC-MS中通过背景扣除(样品减除空白基质)可以找到另一个主要产物M2的质谱峰(图10)。经一级质谱和二级质谱的信号比对,确认是连接子水解后得到了环肽M1和载荷毒素M2。因为特征紫外吸收主要是环肽的部分氨基酸贡献, M2的紫外吸收较弱,在LC-UV上没有得到有效检出,只能通过LC-MS识别检测。
在肝细胞孵育体系中,因为代谢产物含量低,在LC-UV中没有发现明显的代谢产物峰,在LC-MS中经过背景扣除处理,可以找到两个低含量产物M3和M4 (图11)。经一级质谱和二级质谱信号对比,判断载荷毒素-连接子部分没有发生变化,代谢变化主要是多肽部分发生水解,对比各个氨基酸残基组合的分子量和代谢质量变化,计算得到水解后的肽段信息。




经LC-MS分析和产物结构解析,我们发现该PDC在酸化S9中主要通过连接子水解,释放载荷毒素M2和环肽M1;在肝细胞中则发生环肽上的部分水解产生M3和M4,而连接子保持稳定。从代谢途径差别(图12)可以看出其载荷毒素代谢释放方式也具有肿瘤环境靶向性(相对于肝代谢)。此外,对于偶联类药物中常用的Val-Cit型linker在小鼠血浆中会表现出不稳定,因为在小鼠血浆中高表达的Ces1c酶也可以酶切(人血浆中却含量极低),因此用小鼠作为动物模型研究药代动力学时偏差会较大,也是做代谢研究需要关注和识别的,在对此类化合物研究中,我们也通过体外血浆孵育实验和LC-MS分析确认了小鼠血浆孵育体系中生成的游离载荷毒素远高于人在血浆孵育中的产生。
总结与展望
随着多肽和连接子技术的创新发展,PDC药物具有广阔的发展前景。PDC药物的代谢研究同时包含了对药物的代谢稳定性、靶向性和载荷释放有效性的评估。
基于超高效液相-高分辨质谱(UPLC- HRMS)技术、专业的数据处理软件和丰富的研究经验,药明康德DMPK建立了PDC代谢产物分析和鉴定研究平台,近年来为多家客户提供高质量的服务,助力PDC药物研究快速推进。
作者: 施立琦,覃耿垚,曹卫群
编辑:方健,钱卉娟
设计:倪德伟
喜欢我们的内容,欢迎关注@药明康德市场部!或者点赞、评论、分享给其他读者吧!
合肥科生景肽生物科技有限公司成立于2018年,目前已经打造了全球领先的以肽为核心的生命分子发现、合成生产、结构优化、递送平台,主要瞄准肽发现及靶向递送,专注于为各大制药企业、生物技术公司、科研单位提供一站式的定制化研发服务。 公司独有的KPDS™平台(KS-V Peptide Discovery Services Platform)是国际领先的的多肽药物发现平台,我们致力于创新药物的高效和精准开发,以科生景肽专有KPDS技术为核心,提供一站式,定制化的多肽发现服务,以灵活的产品形式和服务模式助力广大客户各类药物发现项目的快速推进和应用探究,包括但并不限于疾病诊断及保健功能产品、多肽药物、核素偶联药物(RDC)、基于小分子的肽药物偶联物(PDC)和多功能肽偶联物等。中文官网地址:https://www.ks-vpeptide.com.cn/
英文官网地址:https://www.ks-vpeptide.com
领英:https://www.linkedin.com/company/ks-v-peptide/