
浙江省免疫学会副理事长/临床免疫专委会主委/浙江大学医学院附属第二医院乳腺外科 黄建教授、浙江省免疫学会临床免疫专委会常委/浙江大学临床百人/浙江大学医学院附属第二医院乳腺外科 倪超副主任医师团队 及 浙江大学国际医学院附属第四医院遗传医学研究所/浙江大学百人计划研究员 蒋明教授团队,与恩泽康泰在组织外泌体、血浆外泌体和类器官外泌体的分离以及全转录组测序方面展开深度合作。
以往研究主要集中在来自细胞培养模型或体液的小细胞外囊泡(sEVs),而该研究以乳腺癌(BC)为例,首次强调了组织特异性的sEVs的重要性,并多维度比较了其与体外模型中的差异。研究成果以《Integrated transcriptomics, proteomics, and functional analysis to characterize the tissue-specific small extracellular vesicle network of breast cancer》为题,于2023年12月3日发表在MedComm(IF=9.9)。

 研究思路
研究思路

研究入组了10名BC患者的新鲜BC组织、配对正常乳腺组织和外周血,全面表征了来自乳腺癌组织(T-sEVs)、配对正常组织(N-sEVs)、相应血浆(B-sEVs)和肿瘤类器官(O-sEVs)小细胞外囊泡的转录组学和蛋白质组学特征。
 研究发现
研究发现
该研究表征T-sEVs、N-sEVs、B-sEVs和O-sEVs的转录组学和蛋白质组学特征,确定了以富集细胞粘附以及免疫调节分子为特征的真实乳腺癌原位sEVs网络;揭示了癌症相关成纤维细胞(CAFs)在肿瘤微环境(TME)sEVs网络中的重要贡献;同时,研究表明体外模型衍生的sEVs不完全继承T-sEVs的细胞外基质(ECM)和免疫调节相关特征;与O-sEVs相比,T-sEVs对巨噬细胞和CD8+ T细胞具有更强的免疫刺激能力。此外,循环中非癌细胞衍生的某些sEVs生物标志物显示出有价值的诊断潜力。该研究针对肿瘤组织来源的sEVs的功能特征,提供了有价值的见解,突出了它们作为诊断标志物以及乳腺癌治疗靶点的重要潜力。
 研究结果1.不同来源的sEVs的分离及鉴定
研究结果1.不同来源的sEVs的分离及鉴定
首先,研究通过形态学和免疫组化染色证明了肿瘤类器官的成功建立,利用透射电子显微镜(TEM)观察到BC组织间隙中sEVs的存在。接下来,分离了组织外泌体T-sEVs、以及体外模型类器官外泌体O-sEVs 和 血浆外泌体B-sEVs,并进行了TEM、纳米颗粒跟踪分析(NTA)和蛋白质印迹(WB)三项鉴定。

图1.不同乳腺癌模型sEVs的分离和鉴定。(B)乳腺癌组织和配对类器官中雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体-2(HER2)的免疫组化染色代表图(标尺,100 μm);(C)高放大倍率图片显示乳腺癌组织间质中有大量sEVs;(D)多模型衍生sEVs的代表性透射电镜图(标尺,0.5 μm);(E)多模型衍生sEVs的NTA分析;(F)WB分析多模型衍生sEVs中Alix、Tsg101、HSP70、CD9、CD63和Calnexin的表达水平,细胞裂解物作为对照。
2.通过比较T-sEVs和N-sEVs来识别癌症特异性sEVs特征对肿瘤组织来源的sEVs以及配对的正常乳腺组织来源的sEVs进行转录组学和蛋白质组学分析,通过对肿瘤特异性sEVs的mRNA/microRNA通路网络以及蛋白质谱的比较,揭示了肿瘤特异性sEVs具有显著的免疫以及间质微环境调控功能,前者涉及中性粒细胞胞外陷阱(NET)的形成、Th1和Th2细胞分化以及抗原加工和提呈等过程,后者包括整合素连接、细胞外基质结构重塑以及胶原连接等过程。
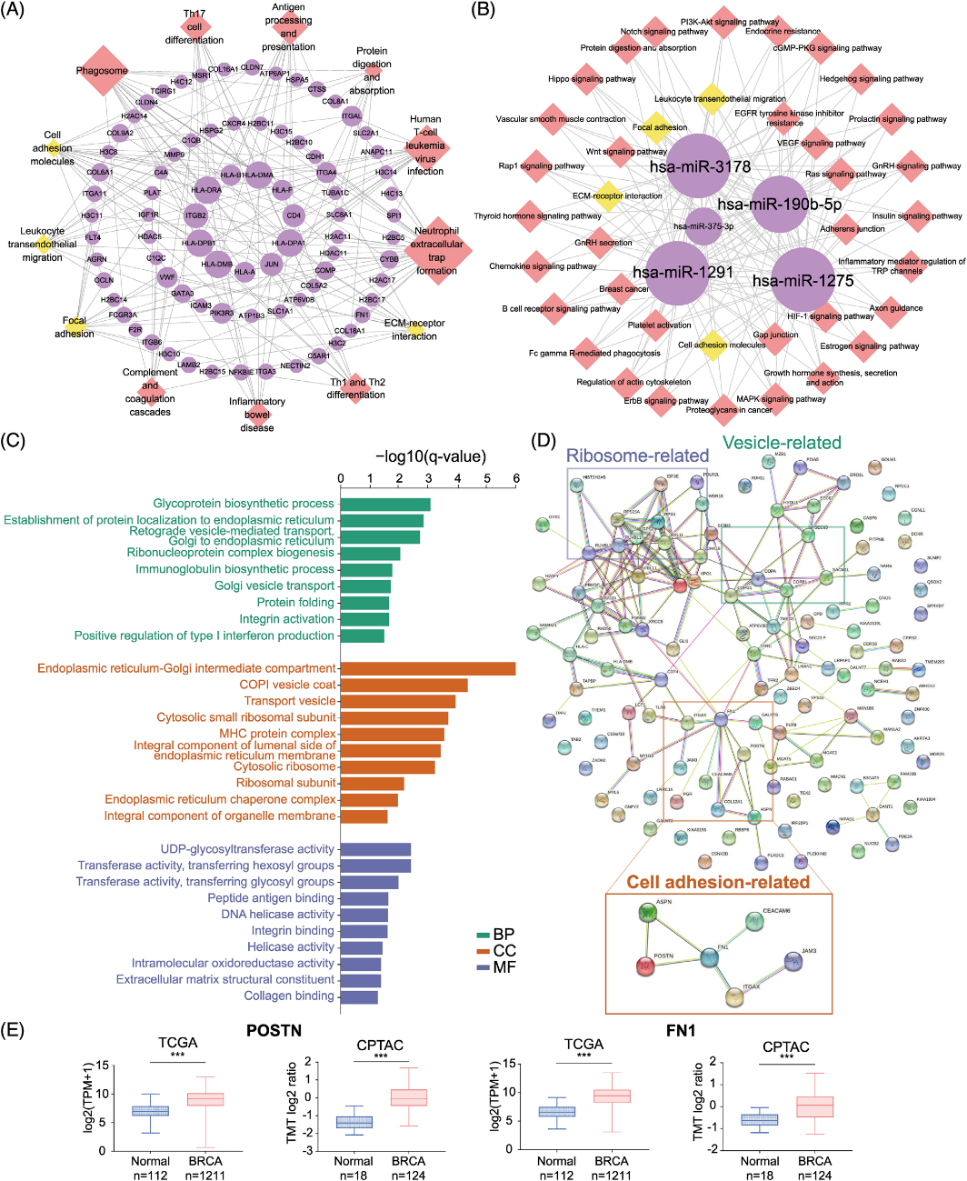
图2.新鲜组织来源的sEVs的转录组学和蛋白质组学分析揭示了乳腺癌特异的sEVs特征。对肿瘤特异性sEVs mRNA(A)和microRNA(B)的靶基因进行KEGG分析,并通过Cytoscape软件可视化;(C)T-sEVs与N-sEVs的差异蛋白(FC>4,p < 0.05)的GO分析;(D)T-sEVs与N-sEVs的差异蛋白间相互作用网络;(E)基于TCGA-BRCA和CPTAC-BRCA数据检测正常组织和乳腺癌组织中POSTIN和FN1的转录组学和蛋白质组学水平。***p < 0.001。
3.预测TME内sEVs的细胞来源根据mRNA测序数据和scRNA-seq数据库,应用scMappR确定跟踪的细胞类型,发现CAFs是主要贡献差异基因的细胞亚型。相应的高度富集的通路也表明了CAFs的经典生物学功能,包括促进肿瘤进展、血管发育和ECM重塑。根据蛋白质组和公共scRNA-seq数据,分析了T-sEVs的细胞来源:肿瘤上皮细胞是肿瘤组织中最主要的sEVs细胞来源,其次是CAFs,且单个CAFs较肿瘤上皮细胞具有更强的sEVs分泌能力。

图3. CAFs是TME中sEVs网络的主要贡献细胞类型。(A)T-sEVs相比于N-sEVs上调的差异基因的归一化cwFold变化排序的追踪细胞类型的热图(FC>1.5,p < 0.05);(B)T-sEVs相比于N-sEVs上调的差异基因及相应的细胞类型特异性富集通路的热图;(C)蛋白质组数据和公共scRNA-seq数据评估组织来源sEVs的细胞来源示意图;(D)每簇细胞数占总细胞数的比例(Cell%)以及每簇细胞数来源的T-sEVs占总细胞数来源的T-sEVs的比例(组织-sEVs%);(E)单个细胞的sEVs占总sEVs比例;(F)每个细胞簇Log(组织-sEVs%/细胞%)的值表示免疫和非免疫细胞的分类。
4.体外模型大部分丢失的特征来源于CAFs衍生sEVs考虑到个体间sEVs中mRNA/microRNA表达的异质性,使用七个完全配对样本(N-sEVs、T-sEVs和O-sEVs)的数据来探索个体体外模型中sEVs的基因水平。通过分析体外培养模型中丢失的mRNA、microRNA以及蛋白组分,发现与ECM和黏附相关的途径以及免疫调节途径相关的sEVs组分,包括单核细胞、髓细胞、B细胞和Th1/2细胞的分化以及T细胞毒性的调节,更容易在类器官培养模型中的sEVs中丢失。进一步分析表明,CAFs衍生sEVs占据了体外培养模型来源丢失的sEVs的绝大部分。

图4.肿瘤特异性sEVs在类器官培养模型中丢失。(A)O-sEVs丢失的癌症特异性sEVs的定义图示;(B)O-sEVs中丢失mRNA在不同来源的sEVs中的相对表达水平的热图;(C)O-sEVs丢失的癌症特异性sEVs mRNA GO和KEGG富集分析;(D)O-sEVs中丢失的microRNA在不同来源的sEVs中的相对表达水平的热图;(E)已知的microRNA靶基因调控的KEGG通路热图;(F)维恩图显示重叠的癌症特异性mRNA(n = 93)和miR-190b-5p在体外模型中丢失,但至少在4个组织样本来源的sEVs中表达;对93个基因进行了GO(G)和KEGG分析(H)。
5. T-sEVs和O-sEVs在调节肿瘤细胞和免疫细胞中的独特功能体外实验比较T-sEVs与O-sEVs的生物学功能,结果显示,相比于O-sEVs,T-sEVs对巨噬细胞和CD8+ T细胞具有更强的免疫刺激能力,表明了sEVs相关的研究,特别是源自肿瘤细胞本身的sEVs,可能严重低估了TME中sEVs网络的生物学功能,因此在体外患者来源的类器官中评估的免疫疗法的疗效有可能被低估。

图5.来源于肿瘤组织的sEVs具有独特的肿瘤和免疫调节能力。(A)MCF7和THP-1摄取dil标记的O-sEVs(左)和T-sEVs(右)(标尺,50 μm);(B)等量的O-sEVs、T-sEVs对MCF7细胞进行细胞周期分析的代表性流式细胞图(左)和统计分析(右)(n = 5);(C)等量O-sEVs、T-sEVs对THP-1上CD86、CD163和CD206表达水平影响(n = 5);(D)等量O-sEVs、T-sEVs孵育外周血CD8+ T细胞,对IFN-γ和TNF-α进行胞内流式分析(n = 3)。*p < 0.05,**p < 0.01。
6. BC 中癌症特异性sEVs的诊断价值的鉴定研究分析发现15种mRNA(HLA-DRA、OAS2、ABRACL、COX6C、GAPT、SHMT2、RAB3D、SPI1、KIAA0040、RNF4、CDC42SE1、ORAI2、DENN2D、LMNB1和HMGA1)在T-sEVs、B-sEVs、BC患者的血液样本以及TCGA BC肿瘤组织中高表达。为了评估组合的诊断价值,建立了诊断模型并使用支持向量机(SVM)算法生成BC的特征。在训练队列中,区分BC患者与健康人的AUC为0.893;应用于验证队列时,AUC为0.841。

图6. BC诊断中潜在sEVs生物标志物的鉴定。(A)在B-sEVs和癌症特异性sEVs中鉴定出24个sEVs mRNA;(B)15个候选mRNA在N-sEVs和T-sEVs中的表达水平热图;(C)基于exoRbase的健康和BC患者B-sEVs中15种mRNA的水平,以及基于TCGA-BRCA数据的正常和BC组织中15种mRNA的水平(D);(E)基于exoRbase的受试者工作特征(ROC)曲线分析结果;(F)在训练和验证队列中的ROC曲线分析;(G)TCGA数据库中COX6C、GAPT、KIAA0040和DENND2D在正常和不同亚型BC中的表达水平。*p < 0.05,**p < 0.01,***p < 0.001。
 研究总结
研究总结

研究首次通过配对的肿瘤组织、癌旁正常组织、类器官模型、组织切片培养、外周血,多维度、多组学、系统性地阐述了乳腺癌组织特异性sEVs网络特征,发现CAFs在sEVs网络中占有很大的比重,提示其在远端肿瘤转移前微环境可能发挥了重要作用;同时,乳腺癌组织衍生sEVs被证实有着更强的免疫刺激功能,提示其具有作为癌症疫苗的重要潜力;此外,循环中具有诊断价值的候选sEVs生物标志物可能来源于癌症相关的基质细胞,而非癌细胞本身。该研究在揭示肿瘤组织sEVs网络的复杂性质方面迈出了重要的一步,将更加有助于未来对于细胞外囊泡生物学行为及诊断方法学的研究。
关于恩泽康泰
北京恩泽康泰生物科技有限公司是致力于外泌体技术开发与临床转化的创新型高科技公司。恩泽康泰将十余年的外泌体基础研究与分子生物学、细胞生物学及生物信息学相结合,建立了外泌体研究与转化平台,与国内300+重点医院建立合作,合作发表论文100+,涉及样本类型100+,数量30000+,目前累计获得多轮数亿元融资。参与撰写外泌体专家共识,并与中国细胞外囊泡学会联合举办《外泌体大讲坛》(已开展专家讲座50余期)。现已入选“专精特新小巨人企业”、“博士后科研工作站”、“北京市专精特新中小企业”、“国家高新技术企业”、“中关村高新技术企业”、“中关村金种子企业”等。
公司业务分为两个板块,一方面基于自主的平台提供领先的生命科学研究服务,以外泌体组学平台—Exoomics®为核心的高通量多组学解决方案和工程化外泌体改造平台—ModiExo®为核心的基础研究解决方案等丰富的产品线,并且围绕客户需求不断推出高效的外泌体研究工具;另一方面是基于自主的工程化外泌体平台-Echosome®赋能外泌体创新药研发,现已建成3000平米外泌体GMP中试车间,并且建立成熟的外泌体生产工艺和质量表征体系,可提供工程化外泌体载体设计开发、工程化外泌体药物PCC开发等CRO服务及工程化外泌体的CDMO服务。
公司致力于通过提供系统的外泌体研究与转化解决方案,赋能临床科研,加速临床转化,成为外泌体研究与转化合作伙伴
合肥科生景肽生物科技有限公司成立于2018年,目前已经打造了全球领先的以肽为核心的生命分子发现、合成生产、结构优化、递送平台,主要瞄准肽发现及靶向递送,专注于为各大制药企业、生物技术公司、科研单位提供一站式的定制化研发服务。 公司独有的KPDS™平台(KS-V Peptide Discovery Services Platform)是国际领先的的多肽药物发现平台,我们致力于创新药物的高效和精准开发,以科生景肽专有KPDS技术为核心,提供一站式,定制化的多肽发现服务,以灵活的产品形式和服务模式助力广大客户各类药物发现项目的快速推进和应用探究,包括但并不限于疾病诊断及保健功能产品、多肽药物、核素偶联药物(RDC)、基于小分子的肽药物偶联物(PDC)和多功能肽偶联物等。中文官网地址:https://www.ks-vpeptide.com.cn/
英文官网地址:https://www.ks-vpeptide.com
领英:https://www.linkedin.com/company/ks-v-peptide/
















