来源:生物世界

 撰文丨nagashi
撰文丨nagashi编辑丨王多鱼
题图为论文第一作者吕剑昆博士
人工智能(AI)的兴起正在引发人类社会的新变革,并在科学研究、医学诊断、计算机和金融贸易等领域的应用越来越多,覆盖人们衣食住行的方方面面。在临床治疗应用上,AI带来了全所未有的创新,从确定肿瘤患者的最佳治疗方案,到识别新的蛋白质-配体相互作用,再到新型治疗药物的发现,AI的革命性的作用已呼之欲出。
值得一提的是,此前大部分AI医学研究是回顾性的,通常是将具有已知交互作用的重要和特定数据输入人工智能软件以回答特定问题。但也有一些前瞻性研究开始利用人工智能作为预测工具,辅助药物研发,例如蛋白质结构预测工具AlphaFold2。
2024年5月16日,洛克菲勒大学吕剑昆、北卡罗来纳大学教堂山分校 Bryan Roth、加州大学旧金山分校 Brian K. Shoichet、哈佛大学医学院 Andrew C. Kruse、斯坦福大学医学院 Georgios Skiniotis 等人在国际顶尖学术期刊 Science 上发表了题为:AlphaFold2 structures guide prospective ligand discovery的研究论文。
该研究表明,AlphaFold2在生成蛋白质的3D模型以及预测配体结合能力方面是十分有效,这一AI模型可以对与配体发现相关的构象进行采样,大大扩展了基于结构的配体发现的适用性领域。这项研究也提示我们,AlphaFold2对新药发现具有极大潜力。

AlphaFold2是谷歌旗下公司DeepMind开发的一款人工智能程序,其强大的蛋白质结构预测能力震惊世界,达到了人类利用冷冻电镜等复杂仪器观测的水平,这是蛋白质结构预测领域史无前例的巨大进步。AlphaFold2的两位开发着Demis Hassabis 和 John Jumpe 更是获得了今年的诺贝尔化学奖。
基于AlphaFold2在预测蛋白质的3D结构的优异表现,这一人工智能系统可用于帮助识别多种候选药物。Bryan Roth教授表示,AlphaFold2极大地扩展了基于结构的配体数量,尽管回顾性研究对它们对这一目标的直接作用提出了质疑,但可能低估了AlphaFoldF2结构预测对新配体发现的能力。
在这项发表于 Science 的研究中,研究团队旨在确定AlphaFold2不仅可用于预测潜在药物与已知配体的结合相互作用的可能性,还可以用于确定未知蛋白质中的配体结合位点,并预测其与潜在配体的相互作用。
因此,研究团队聚焦于两种蛋白——sigma-2(σ2)和5-HT2A,这两种蛋白以前没有用于AlphaFold2训练。sigma-2和5-HT2A属于两个不同的蛋白质家族(EXPERA和GPCR家族),两者在细胞间通讯中发挥重要作用,是治疗包括阿尔茨海默病、精神分裂症及抑郁症在内的神经系统疾病的潜在药物靶点。
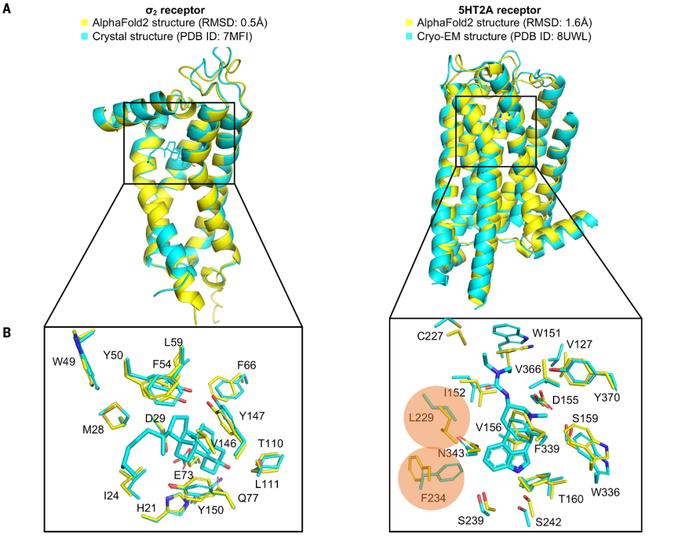 AlphaFold2的预测结构和实验解析结构之间的差异
AlphaFold2的预测结构和实验解析结构之间的差异AlphaFold2围绕sigma-2和5-HT2A展示了具有多种可能结合位点的3D结构,研究团队通过冷冻电镜和X射线晶体衍射对AlphaFold2预测的5-HT2A配体的结构进行了测定,发现了与AlphaFold2预测相似的氨基酸残基调节。
研究结果显示,实验解析结构和AlphaFold2预测结构的命中率很高,相似度和亲和力也是如此。此外,尽管正交氨基酸残基构象与实验结构结构存在差异,但与AlphaFold2模型的对接仍取得了成功。
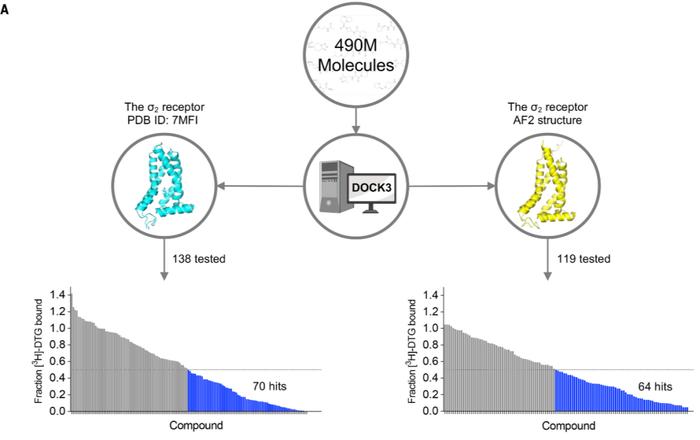 对sigma-2受体晶体结构和AlphaFold2结构的前瞻性筛选比较
对sigma-2受体晶体结构和AlphaFold2结构的前瞻性筛选比较接下来,研究团队通过回输实验数据给AlphaFold2,从而对配体结合进行第二次回顾性研究。基于实验和AlphaFold2,采用前瞻性和回顾性模型预测了多达16亿个候选药物。这一研究结果表明,与基于回顾性模拟的想法相比,AlphaFold2可能与基于前瞻性结构的配体发现更相关。
虽然模型的输出有一定的差异,但模型之间的成功率没有显著差异。对于sigma-2蛋白,基于AlphaFold2结构的蛋白质-配体相互作用的命中率为54%,基于晶体结构的命中率为51%。同样,对于5-HT2A蛋白,基于AlphaFold2结构的命中率为26%,基于冷冻电镜结构的命中率为23%。
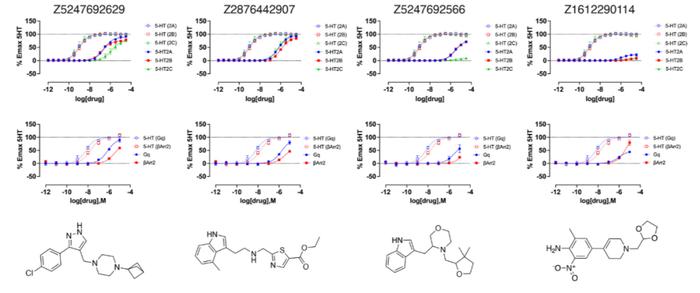 AlphaFold2用于配体预测
AlphaFold2用于配体预测总的来说,这项发表于 Science 的研究表明,AlphaFold2模型可以获得与实验解析结构不同但能量低且与配体发现相关的构象,扩展了基于结构的配体发现领域。因此,在这项研究中使用这些蛋白质既有助于测试AlphaFold2等AI预测模型的功能,也可能为治疗这些和其他神经系统疾病的候选药物研究提供可操作的数据。
Bryan Roth 教授总结道,通过AlphaFold2,理论上创造药物的可能性几乎是无限的,并且可以达到治疗疾病的预期目标,这种人工智能工具是非常宝贵的。接下来,研究团队将测试这些结果是否适用于其他治疗靶点和靶点类别。

吕剑昆
论文第一作者兼共同通讯作者吕剑昆博士,2013年本科毕业于华东理工大学,2019年获得华东理工大学药学博士学位,此后在加州大学旧金山分校 Bryan Roth 教授实验室从事博士后研究,2023年加入洛克菲勒大学,任助理教授,致力于利用人工智能筛选化合物库以发现新兴治疗靶点的新配体。
论文链接:
https://www.science.org/doi/10.1126/science.adn6354
合肥科生景肽生物科技有限公司成立于2018年,目前已经打造了全球领先的以肽为核心的生命分子发现、合成生产、结构优化、递送平台,主要瞄准肽发现及靶向递送,专注于为各大制药企业、生物技术公司、科研单位提供一站式的定制化研发服务。 公司独有的KPDS™平台(KS-V Peptide Discovery Services Platform)是国际领先的的多肽药物发现平台,我们致力于创新药物的高效和精准开发,以科生景肽专有KPDS技术为核心,提供一站式,定制化的多肽发现服务,以灵活的产品形式和服务模式助力广大客户各类药物发现项目的快速推进和应用探究,包括但并不限于疾病诊断及保健功能产品、多肽药物、核素偶联药物(RDC)、基于小分子的肽药物偶联物(PDC)和多功能肽偶联物等。中文官网地址:https://www.ks-vpeptide.com.cn/
英文官网地址:https://www.ks-vpeptide.com
领英:https://www.linkedin.com/company/ks-v-peptide/