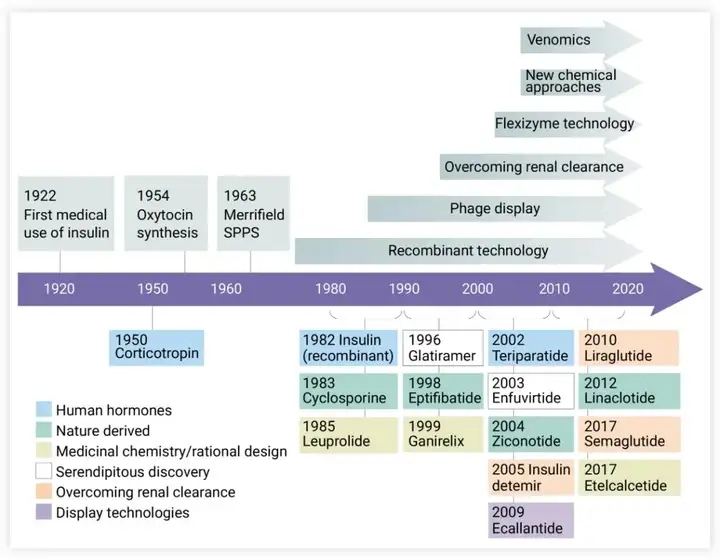
抗体偶联药物(antibody drug conjugate,ADC)被誉为肿瘤治疗的“魔法子弹”(magic bullets),因为它有效结合了抗体部分的肿瘤靶向性及细胞毒药物部分的效力。ADC通常由三部分构成,即抗体、连接子和载荷。设计和优化这三个组成中的任一部分,即可以生成新型的ADC药物。
经过起步阶段一段缓慢的发展过程后,ADC领域目前正行驶在快车道。截至2023年7月,全球已获批在进行销售的ADC药物已达13种(不包括阿斯利康撤市的Lumoxiti)。其中,6个ADC产品靶向血液瘤中的6种不同抗原(CD33、CD30、CD22、CD79b、BCMA和CD19),7个ADC产品靶向实体肿瘤中表达的5种不同抗原(HER2、nectin-4、TROP2、TF和FRα)。
已上市ADC产品汇总(来源:公开资料整理)
13个上市ADC的偶联形式分为基于铰链区半胱氨酸偶联(DAR值4至8)或随机赖氨酸偶联(DAR 值2至5)。有一点值得关注,尽管定点偶联技术的ADC在体内外试验中都显示出良好的效果,但到目前为止还没有成功上市的产品。
旁观者杀伤效应(来源https://doi.org/10.1038/s41573-023-00709-2)
此外,13个上市ADC中的11个带有可裂解的连接子,从而产生旁观者杀伤效应(bystander-killing effect )。
ADC药物的早期开发过程
ADC中三个部分的不同优化组合形式千变万化,显然不存在一个成功通用的开发模式。如何进行抗体的筛选和优化,怎样挑选有效的药物载荷,在哪个位点及如何将连接子-载荷连接到抗体上,每个抗体连接多少个药物载荷分子才能最佳?想要在后续的临床试验中取得良好的疗效并成功商业化,在ADC的早期研究阶段就要着手解决上述的这些问题,从而找到特定的抗体、连接子及载荷的组合。药明合联在ADC药物的早期发现阶段提供了涵盖靶点筛选、抗体开发、载荷-连接子合成及生化分析技术平台,主要包括以下流程:
抗体筛选和优化
抗体对目标抗原的亲和力极为重要,高亲和力的抗体可以确保载荷肿瘤细胞内有更好的富集,低亲和力抗体体内降解速率较慢且能够更有效地穿透实体瘤组织。此外,保证抗体的高质量可以在后续开发过程中降低ADC的工艺开发及分析方法开发难度,提高ADC药物研发成功率。液相色谱、电泳和质谱法已经成熟运用于单克隆抗体发现、临床前和临床开发的各个阶段。这些分析技术在ADC研发过程中有助于选择最佳单克隆抗体,以便后续进行完整的药物结构表征。这些检验技术还用于识别并排除抗体上可能对后续ADC稳定性以及药代动力学和药理学特性有影响的因素。
基于多年的抗体药研发经验,药明合联在ADC药物中抗体筛选和优化方面具有行业领先的竞争优势:
人工智能辅助抗体密码子优化
基于CRISPR/Cas9的工程化改造能力
丰富的蛋白表达平台:大肠杆菌,昆虫细胞,CHO,NS0,HEK-293
高产量且高质量的毫克到百克的样品快速制备能力,在几个星期内即可交付。
载荷(Payload)有效载荷是ADC发挥细胞毒性作用的关键组成部分,通常来说需要满足以下要求:合适的细胞毒性(pmol到nmol水平的IC50值)、明确的靶点和作用机制、具有化学连接位点。通常为微管合成抑制类和DNA损伤类药物,如上图上市药物中的MMAE、DM1、DXd及PBD等。连接子(Linker)连接子不仅是在抗体和载荷之间形成共价连接的分子组成部分,而且在靶向药物治疗中发挥着关键作用。linker不应诱导药物聚集,需具备良好的PK特性,同时避免在血浆中过早释放有效载荷(稳定性)。连接子分为不可裂解和可裂解两种类型。药明合联具有丰富的载荷-连接子选择方案,可满足客户的各种需求:持续增加的载荷连接子库:VC-MMAE, MC-MMAF, GGFG-Dxd, CL2A-SN38, SMCC-DM1, SPDB-DM4, Tesirine……符合GMP及非GMP的要求的常用载荷和连接子库存;载荷:MMAE, MMAF, DM1, DM4, SN38, Exatecan mesylate, PNU159682, PBD……连接子:MC-VC-PAB-PNP, Glu-VC-PAB, NHS-Glu-VC-PAB, Azido-Glu-VC-PAB, Hydrazone (acid Sensitive), Disulfide (Glutathione sensitive), SMCC……药物主文件(DMF):vcMMAE, MCMMAF, Exatecan Mesylate定制化的载荷连接子合成生物偶联(Bioconjugation)ADC候选药物临床研究效果的好坏,不仅取决于有效载荷的效力、连接子的稳定性和有效的药物释放,还取决于抗体和生物偶联技术的选择。过去二十几年间,尽管位点偶联技术已取得长足的发展,但大多数已获批的ADC仍是以混合物的形式存在。而高的药物/抗体比值(DAR)通常导致体内半衰期短,低DAR值则表现出较弱的肿瘤杀伤活性。同时,混合物中的裸抗会成为ADC的竞争性抑制剂。因此,需要一些新的生物偶联策略来有效控制载荷的位置和数量,同时保持ADC结构的完整性和均一性。药明合联在ADC药物的研制过程中,参与超过340个ADC早期研发项目,对多种偶联技术具有丰富经验:内源性氨基酸残基位点的偶联(赖氨酸,半胱氨酸残基);定点偶联:ThioMab, 酶介导的偶联,基于非天然氨基酸的偶联等;创新的WuXiDAR4技术,优化并严格控制DAR值,DAR4得率在65%以上;
一体化生物偶联药物先导分子筛选平台
ADC发现及开发过程涉及对生物大分子及小分子化合物双方面的跨形式专业知识。在探索偶联的发现过程中,广泛探索不同偶联方法十分重要,尤其是在处理不太稳定的抗体或高疏水性连接子及有效载荷时。此外,需要相当的专业知识来调整特定的期望DAR值及药物载荷分布。同时,由于每项研究涉及不同的分子类型,因此通用的分析表征方法必不可少。
药明合联具有对高活ADC和其他生物偶联物进行各种生物学分析的经验和专业知识,建立了完善的体外及体内研究体系:
结合实验(ELISA、FACS、SPR)、竞争结合实验细胞实验:增殖实验 (CellTiter Glo)、内化试验(pHrodo、酸洗)、细胞凋亡实验、血管生成实验等。Fc效应功能研究:ADCC实验,CDC实验,吞噬作用实验。小鼠PK和药效研究探索性毒性研究
此外,药明合联通过上下游团队间的高效无缝衔接,可以确保CMC阶段开发工作更高效开展。同时,业内资深技术专家从报价到交付,对项目全面把控,支持与客户的技术讨论,使得整体ADC的早期研发周期控制在10个月以内。
小结
近年来,ADC的三个重要组成部分都有了长足的发展。得益于各种分子建模工具,化学方面建立了一系列连接药物载荷的发现和评价方法,丰富了可用的载荷库。通过系统研究连接子的化学性质与ADC特性之间的关系,带来了ADC迭代式创新设计。而单克隆抗体的选择性工程化改造以及创新型工艺技术的应用使得ADC的均一性到了更好控制。首个ADC药物获批上市已经过去了二十多年,ADC在临床肿瘤治疗上带来了越来越显著的影响。此外上市ADC的销售额也快速增长,其中三个药物在2022年的销售额超过了10亿美元,进入“重磅炸弹”梯队。即使ADC的开发过程比抗体更复杂,但临床上的成功表现使得人们对ADC的未来充满期待。在可预见的将来,获批ADC的数量将大幅增加,并将满足日益增长的常见病和罕见病未满足的患者临床需求。
合肥科生景肽生物科技有限公司成立于2018年,目前已经打造了全球领先的以肽为核心的生命分子发现、合成生产、结构优化、递送平台,主要瞄准肽发现及靶向递送,专注于为各大制药企业、生物技术公司、科研单位提供一站式的定制化研发服务。 公司独有的KPDS™平台(KS-V Peptide Discovery Services Platform)是国际领先的的多肽药物发现平台,我们致力于创新药物的高效和精准开发,以科生景肽专有KPDS技术为核心,提供一站式,定制化的多肽发现服务,以灵活的产品形式和服务模式助力广大客户各类药物发现项目的快速推进和应用探究,包括但并不限于疾病诊断及保健功能产品、多肽药物、核素偶联药物(RDC)、基于小分子的肽药物偶联物(PDC)和多功能肽偶联物等。中文官网地址:https://www.ks-vpeptide.com.cn/
英文官网地址:https://www.ks-vpeptide.com
领英:https://www.linkedin.com/company/ks-v-peptide/