多肽 or 蛋白?
与蛋白质一样,多肽也是由氨基酸通过肽键连接构成的生物分子,那么如何界定一个分子是多肽还是蛋白?在医药领域,FDA规定了由不超过40个氨基酸组成的序列为多肽,而高于40个氨基酸则为蛋白[1],但这一界定是基于药品监管的便利性,并不普适。
另一方面,可以从结构的复杂程度来理解,一般来说蛋白质的结构颇为复杂,由较长的多肽序列以及不同序列通过非共价键连接后折叠扭曲而来,具有明显的复杂立体结构特征。多肽的结构则较为清晰,链状或环状多肽空间结构排列远比蛋白质简单,近年来随分析技术发展,例如色谱技术、核磁技术、XRD技术等,已可以快速明确的鉴定出多肽的分子/原子级结构。
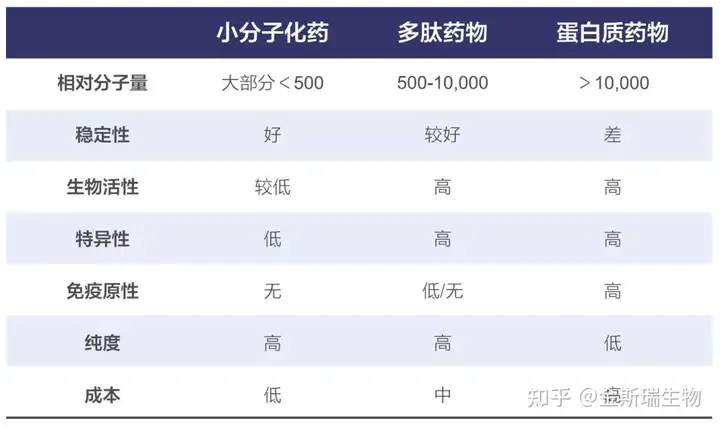
多肽集合了小分子与生物大分子的优点,既拥有类似大分子抗体药物的较强靶向性与亲和力,又拥有类似小分子的快速组织渗透能力,此外,多肽拥有自然来源的特性,安全性优异,是药物开发中优秀的候选分子。另外,多肽在食品、化妆品等领域也有丰富的应用。仍以多肽药物为例,其与小分子和蛋白质药物相比有诸多优点:
短肽与长肽
从多肽组成结构来看,序列包含的氨基酸数量必然成为多肽的关键属性,即多肽“长度”,通常人们将氨基酸数量较少的序列成为“短肽”,更多氨基酸组成的序列称为“长肽”。
当然究竟多“长”才能算作长肽并没有明确的定义,不过,从现今多肽在药物、疫苗领域的应用角度来看,多肽长/短的理解是相对的。
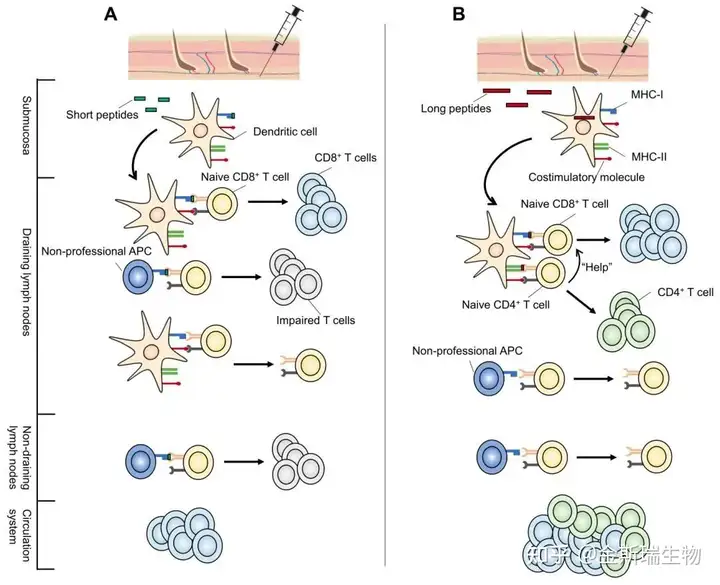
以基于多肽的肿瘤疫苗为例,在刚开始通常使用8-10AA长度的多肽作为疫苗诱发T细胞响应,然而随后的临床应用发现,这些短肽并不能总能够诱导免疫响应,甚至在一些案例中,这些短肽表现出了刺激肿瘤细胞生长的趋势,后续研究表明,这些短肽可能更容易导致肿瘤的免疫耐受,采用更长的序列(15-31AA)则有效的弥补了这种缺陷,在后续的实验研究中也证实了这一点,相对初始的8-10AA,15-31AA的“长肽”成为了后续肿瘤多肽疫苗研究应用的主流[4]。
“长肽”的应用
并不仅限于肿瘤疫苗,多肽在药物、新型疫苗、功能性多肽等领域均有长足的研究与应用。而多肽序列的长度也随着研究深入不断提升,从低于10AA,拓展至100AA以上,越来越多的“长肽”被开发并因特殊的生理活性被报道。
1. 治疗性药物
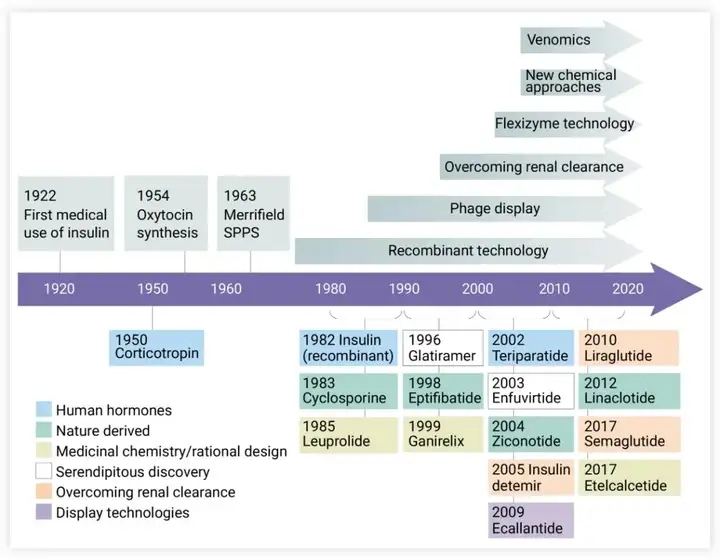
自1923年胰岛素成为第一种商用多肽药物以来,多肽药物已走过近百年历程,现在,多肽药物已成为制药市场中极其重要的组成部分,2019年全球销售额超过700亿美元。主要的多肽药物来源有[5]:
天然多肽/激素,例如胰岛素、GLP-1,GnRH,催产素等等;改性/模拟激素多肽,如GLP-1衍生物/类似物,杜拉鲁肽、利拉鲁肽、索马鲁肽等等;天然产物鉴定,例如来源于蛇、蝎等动物的毒液肽,比如艾塞那肽;基于蛋白质组学/噬菌体展示以及AI设计的新型多肽,新的技术手段引入使得多肽药物发现手段变得更加丰富。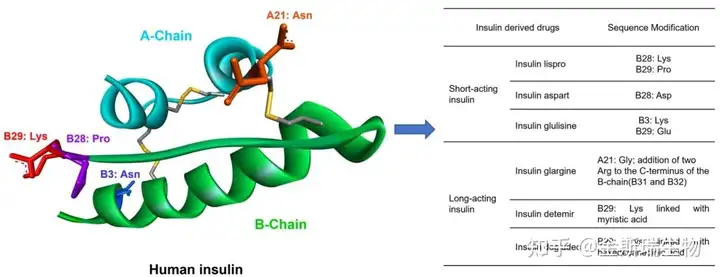
已上市的多肽药物,大部分长度低于40AA,而类似胰岛素(51AA)这样更长的多肽药物,FDA将其归类于蛋白质药物[1]。随着研究的深入,越来越多的多肽药物候选分子被开发并进入到临床研究。
2. 新型疫苗开发
如前所述,合成长肽用于肿瘤疫苗开发已经有诸多应用案例,除肿瘤疫苗之外,合成长肽也用于疟疾疫苗、过敏疫苗等新型疫苗的开发,例如早在2001年,López等人就报道了首次使用合成长肽疟疾疫苗诱发了强烈的人体CD8与CD4 T淋巴细胞响应,该多肽由恶性疟原虫环孢子体蛋白C端区域的部分氨基酸构成(氨基酸282-383),长度超过100AA[6]。
3. 特殊功能性多肽
多肽的高特异性、活性以及安全性,使得越来越多的功能性多肽被研究开发出来,一些多肽呈现抗病毒特性,如恩夫韦肽是第一个批准的药用抗病毒肽,是一种36-氨基酸肽。自新冠疫情以来,抗COVID-19的治疗方法和药物中也包括肽药物的开发[5]。一些多肽也呈现了抗菌特性,研究表明,抗菌肽的主要作用机制是使细菌的细胞膜破裂,从而导致代谢物泄漏,膜去极化,呼吸过程中断,最终导致细菌死亡。此外,还有一些天然多肽,拥有抗氧化、抗皱以及出色的营养学价值,可用于化妆品、食品、保健品等领域[7]。
当然,多肽的应用也受限于多肽的制备难度,尤其在于随序列延长其制备、分离、纯化难度都显著上升。随着研究深入,如何稳定、快速、经济地得到所需的多肽样本也越来越受到重视,相应的多肽制备开发策略也随之不断衍化提升。
多肽的制备
过去,多肽的制备主要集中于自然提取,包括使用蛋白酶将蛋白质水解后经过分离纯化得到多肽,另外,也通过发酵制备得到天然表达的多肽。此外,多肽也可由化学合成的方式得到,化学法合成多肽最早可追溯到上个世纪初,最初的化学合成方式均为经典的液相化学反应[7, 8]。
随着基因重组技术的发展使得多肽的生物合成方法变得灵活与丰富,重组基因可表达各类定向设计的多肽序列,再经过提取与分离纯化得到目标多肽,在规模化制备多肽产品时,重组基因法仍然具有显著的优势。然而,基于生物合成方式的多肽合成仍旧存在一些缺陷,诸如受限于仅可制备天然氨基酸,开发周期长,提取纯化困难等等。
自1963年Bruce Merrifield引入了多肽的固相合成方法(solid-phase peptide synthesis,SPPS),多肽的化学合成掀起了一场革命性变化,SPPS技术极大简化了制备多肽的合成步骤,并且使得规模化、自动化合成多肽成为可能[8]。
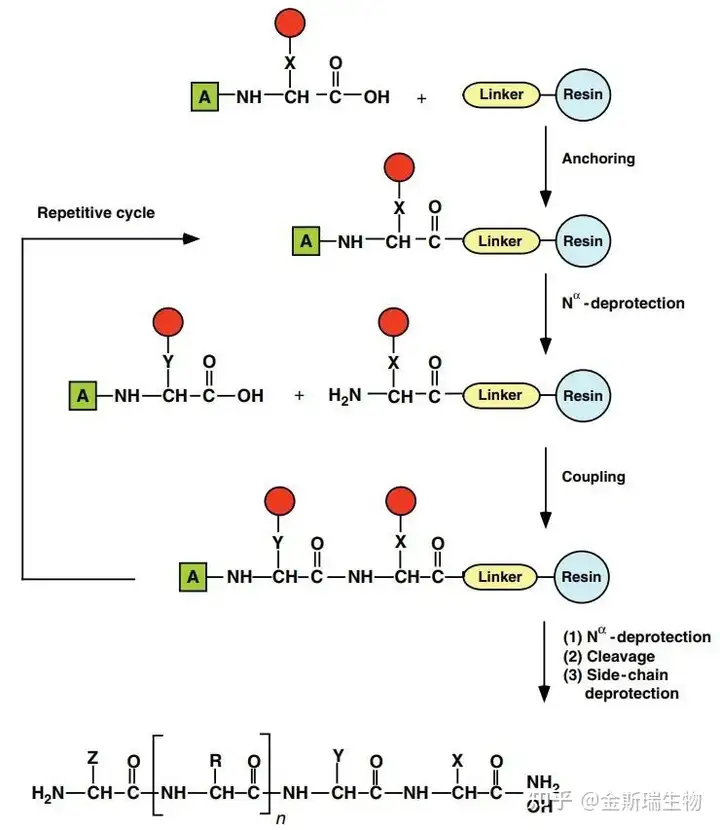
现如今,多肽的固相合成技术已非常成熟,较短的多肽序列都可以通过特定策略快速得到,SPPS已经成为研究用多肽样本制备的绝对主力。然而,SPPS合成的有效性也受限于合成长度的变化,随着序列延长,化学合成的步骤与难度都显著增加,长肽的化学合成仍然面临着挑战。
为提升合成长肽的成功概率与合成效率,诸多合成技术改进已经被开发出来并成功应用,包括:
收敛与混合合成策略(保护片段缩合);经评估的特定偶联温度(PurePep Chorus);微波合成技术(Liberty blue);特定化学修饰结构单元的引入,如伪脯氨酸;减少树脂上的多肽负载;高离液盐的引入;这些策略在应对SPPS普通序列的合成时十分有效,然而,随多肽序列继续延长其合成难度仍然会显著上升,显而易见的原因包括:长序列的多肽不可避免引入更多偶联效率较低的氨基酸,未能成功偶联的多肽会产生大量缺失肽序列,收率、纯度也随之下降;另外,随序列延长,多肽在树脂上产生折叠与卷曲,会使反应位点难以暴露导致偶联失败;过多的合成步骤导致即使每个步骤的收率很高,累计整体收率也会非常低等等。
解决长肽化学合成难题的另一有效策略是基于片段缩合的合成方式,即通过特定方式将长多肽分为若干片段,分别合成片段之后再通过合适的连接方式将不同片段正确“拼接”。
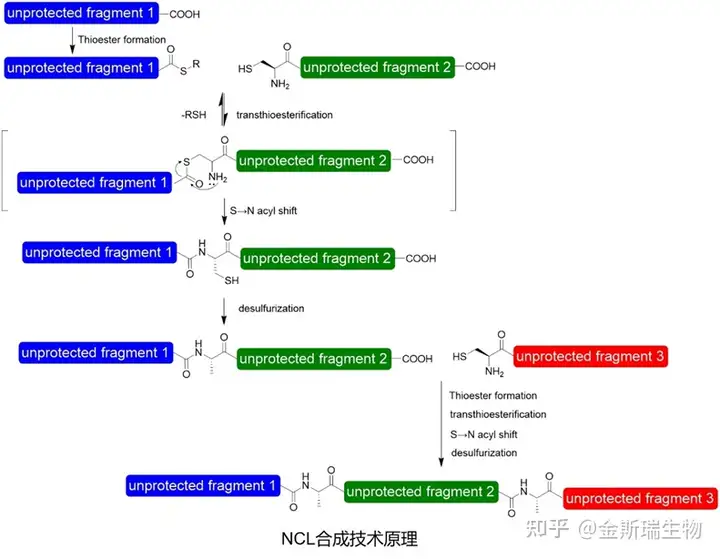
一个典型的方式是基于自然化学连接(Native Chemical Ligation,NCL)技术的长肽合成方法[10],NCL合成技术是片段缩合技术的一种,其优势在于可以在温和的条件下高效连接未保护的多肽片段,主要机理为:1. 将长肽按照半胱氨酸位点拆分为合适的多肽片段,2. 含有N端半胱氨酸的片段与含C端硫酯的多肽片段制备,3. N端半胱氨酸多肽片段与C端硫酯多肽片段在合适条件下进行选择性反应生成联合片段,4.新生成的片段C端硫酯化,继续上述步骤连接更长的片段,上述步骤依次进行从而得到普通合成方法难以合成的长肽序列:
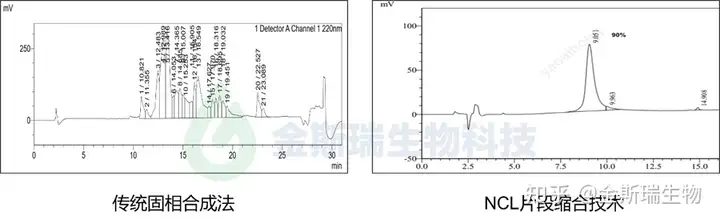
金斯瑞针对一条98AA的多肽序列进行了传统固相合成与NCL合成的对比研究,传统固相合成进行到最后一个步骤时已几乎没有对应产品,而NCL方法则成功获得了高纯度目标产品:
此外,针对长序列的合成效率提升还有包括固相合成片段缩合、酰肼合成法、固液项结合法以及上述提及的合成效率提升的一些额外方法等等,随着合成技术的不断进步,化学合成长肽的长度已可达到200AA以上。
多肽的应用也受益于多肽化学合成技术与表征技术的发展,例如,一些在过去由重组基因制备的药物,也被监管机构允许通过化学合成技术仿制(ANDA)。2017年,FDA发布了指南《ANDAs for Certain Highly Purified Synthetic Peptide Drug Products That Refer to Listed Drugs of rDNA Origin》,批准了胰高血糖素(Glucagon)、利拉鲁肽(Liraglutide)、奈西立肽(Nesiritide)、特立帕肽(Teriparatide)和替度鲁肽(Teduglutide)这5种rDNA来源产品的仿制合成药物可以按照ANDA途径进行申报,并提出了具体的技术要求[1]。
随着更多多肽研究的开展,针对多肽,尤其是长序列多肽合成提出了更高的要求,相对的,多肽合成技术也在发展,合成多肽的效率也在不断提升,这为快速经济的获得多肽研究样本提供了极大便利,而随着更多合成多肽的应用研究成果披露,针对多肽的合成技术也必将更加与时俱进。
金斯瑞多肽合成服务
金斯瑞拥有超过18年多肽合成服务经验,已为全球超过10,000名科学家提供了600,000条之多的优质多肽。自主研发的PepPower™多肽合成平台,整合了微波工艺和多通道自动化技术,极大地提高了合成效率,快至3天交付。依托ISO9001质量管理体系,金斯瑞为多肽合成额外制定了全面质量管理平台,严格的确保每条多肽高质量交付。金斯瑞为多肽尤其是长肽的定制合成制定了完善的解决方案,可提供各类不同长度多肽的快速、高质量合成交付,请与我们联系了解更多详情。
联系信息:邮箱:peptide@genscript.com.cn电话:400-025-8686转5811
参考链接:
[1] ANDAs for Certain Highly Purified Synthetic Peptide Drug Products That Refer to Listed Drugs of rDNA Origin, FDA Guideline, 2017
[2] S.M.Ott. Materials for Bone Disorders, Chapter 2 – Bone Biology and Effects of Pharmaceutical Intervention on Bone Quality. Academic Press. 2017, 29-82.
[3] Corradin, Giampietro et al. “Medicinal application of long synthetic peptide technology.” Expert Opinion on Biological Therapy. 2004, 4: 1629 – 1639.
[4] Chen X, Yang J, Wang L, Liu B. Personalized neoantigen vaccination with synthetic long peptides: recent advances and future perspectives. Theranostics. 2020 May 15;10(13):6011-6023.
[5] Wang, L., Wang, N., Zhang, W. et al. Therapeutic peptides: current applications and future directions. Sig Transduct Target Ther 7, 48 (2022).
合肥科生景肽生物科技有限公司成立于2018年,目前已经打造了全球领先的以肽为核心的生命分子发现、合成生产、结构优化、递送平台,主要瞄准肽发现及靶向递送,专注于为各大制药企业、生物技术公司、科研单位提供一站式的定制化研发服务。 公司独有的KPDS™平台(KS-V Peptide Discovery Services Platform)是国际领先的的多肽药物发现平台,我们致力于创新药物的高效和精准开发,以科生景肽专有KPDS技术为核心,提供一站式,定制化的多肽发现服务,以灵活的产品形式和服务模式助力广大客户各类药物发现项目的快速推进和应用探究,包括但并不限于疾病诊断及保健功能产品、多肽药物、核素偶联药物(RDC)、基于小分子的肽药物偶联物(PDC)和多功能肽偶联物等。中文官网地址:https://www.ks-vpeptide.com.cn/
英文官网地址:https://www.ks-vpeptide.com
领英:https://www.linkedin.com/company/ks-v-peptide/